氟化钠(NaF)的溶解度较小,主要是因为以下几个原因:
1. 晶格能较大:氟化钠的晶格能较大,这意味着氟化钠晶体中的离子键较强。离子键的强度与离子半径和电荷数有关,而氟化钠中的钠离子和氟离子半径较小,电荷数较大,因此离子键较强,导致晶格能较大。晶格能越大,离子从晶体中分离出来所需的能量就越大,因此溶解度就越小。
2. 水合能较小:氟化钠的水合能相对较小。水合能是指离子与水分子之间的相互作用能,当离子与水分子相互作用时,会形成水合离子。水合能的大小取决于离子的电荷数和半径,以及水分子与离子之间的相互作用。由于氟化钠中的钠离子和氟离子半径较小,电荷数较大,因此它们与水分子之间的相互作用较弱,水合能较小。水合能越小,离子与水分子之间的相互作用就越弱,因此溶解度就越小。
3. 水的极性:水是一种极性溶剂,它对离子的溶解能力较强。氟化钠中的氟离子与水分子之间的相互作用较弱,这导致氟化钠在水中的溶解度较小。
4. 溶解度积:氟化钠的溶解度积较小。溶解度积是指饱和溶液中离子浓度的乘积,它是一个衡量离子化合物溶解度的指标。氟化钠的溶解度积较小,这意味着它在水中的溶解度较小。
综上所述,氟化钠的溶解度较小是由于其晶格能较大、水合能较小、水的极性以及溶解度积较小等多种因素共同作用的结果。揭秘氟化钠:为何它在水中的溶解度如此“低调”?
想象你手中拿着一袋白色的粉末,它看起来平平无奇,但你知道吗?这袋粉末中的主角——氟化钠,它在化学界的地位可非同小可。让人好奇的是,氟化钠在水中的溶解度竟然比我们熟悉的食盐——氯化钠要小。那么,氟化钠为什么溶解度小呢?让我们一起揭开这个谜团。

要理解氟化钠溶解度小的原因,我们先得从它的分子结构说起。氟化钠由钠离子(Na+)和氟离子(F-)组成,这两种离子在化学上有着不同的“性格”。
钠离子,这位“大个子”,虽然体积较大,但它的电子云较为松散,容易失去一个电子,形成正离子。而氟离子,这位“小个子”,体积虽小,但它的电子云非常紧密,非常渴望得到一个电子,形成负离子。这种“性格”的差异,使得钠离子和氟离子之间的吸引力非常强,形成了稳定的离子键。
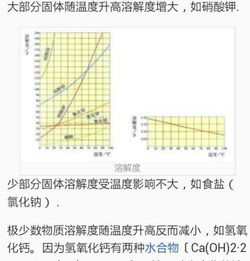
在固态的氟化钠中,钠离子和氟离子像士兵一样排列整齐,形成了一个坚固的晶格结构。这个晶格结构就像一座城堡,保护着里面的离子。而晶格能,就是用来衡量这个城堡坚固程度的指标。
由于氟化钠的离子键非常强,因此它的晶格能也相对较高。这意味着,要将氟化钠中的离子从晶格中分离出来,需要消耗更多的能量。相比之下,氯化钠的晶格能较低,因此它的溶解度相对较高。

水,这位“万能溶剂”,在溶解物质时,会通过破坏溶质分子或离子之间的作用力来实现。对于氟化钠来说,水分子需要消耗更多的能量来破坏其离子键。
这是因为氟离子比氯离子更容易与水分子形成氢键。氢键是一种相对较弱的化学键,但它的存在使得氟化钠在水中的溶解度受到了一定的影响。
温度,这位“调节者”,对溶解度也有着重要的影响。一般来说,随着温度的升高,溶解度也会增加。这是因为温度升高,分子的动能增加,更容易克服溶质分子或离子之间的作用力。
对于氟化钠来说,温度对其溶解度的影响相对较小。这是因为氟化钠的溶解过程是一个吸热过程,需要吸收更多的热量才能使溶解度增加。
pH值,这位“酸碱度”的守护者,也会对溶解度产生影响。对于弱酸性溶质,随着溶液pH值的升高,其溶解度会增大;而对于弱碱性溶质,随着溶液pH值的下降,其溶解度会增大。
氟化钠的水溶液呈弱碱性,因此,当溶液的pH值发生变化时,其溶解度也会相应地发生变化。
来说,氟化钠溶解度小的原因主要有以下几点:离子键的强度、晶格能的高低、溶剂的作用、温度的影响以及pH值的变化。这些因素共同作用,使得氟化钠在水中的溶解度相对较低。了解这些原因,不仅有助于我们更好地理解氟化钠的性质,还能为相关领域的应用提供理论支持。