氟化钠为什么是共价键目录

氟化钠的化学键类型分析-共价键的例外。
在化学中,了解化合物结合的种类对于理解物质的性质和行为非常重要。通常,根据原子电负性的不同,可以知道化合物是形成共价键还是离子键。氟化钠(NaF)例外地被认为是离子键,但实际上存在共价键。下面是氟化钠为什么是共价结合的详细分析。
。
。
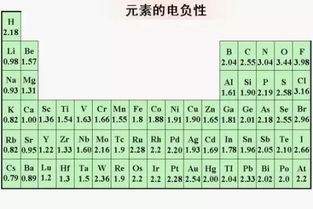
我们需要知道化学键形成过程中的电负性。电负性是原子吸引电子的能力。一般来说,当两个原子的电负性差大于1.7时,它们之间有离子键形成的倾向。如果电负性差小于1.7,则有形成共价键的倾向。氟化钠的情况下,钠(Na)的电负性是0.93,氟(F)的电负性是3.98,比起1.7,3.05的电负性有很大的不同,所以理论上应该形成离子键。
。
。
离子键是通过正负离子之间的静电吸引力形成的,共价键是通过共用原子间的电子对形成的。在氟化钠中,钠原子失去一个电子变成Na。离子,氟原子得到电子,变成F吗?离子。这两个离子在静电引力的作用下结合,形成离子键。这个说法是不正确的
。
。
实际上,在氟化钠的晶体结构中,Na?和F吗?离子之间的相互作用不仅仅是静电引力。随着电子云的重叠,Na?和F吗?离子之间也有共价结合成分。这种共价键是由于电子云相互重叠,两个离子之间的电子密度增加,产生附加的吸引力而形成的。这种吸引力比离子结合的静电引力弱,但在氟化钠的结构中仍然存在。
。
。
氟化钠的共价结合成分约占全部化学键的10%。这种共价键是由Na形成的吗?和F吗?由于离子之间的电子云相互重叠,它们之间具有部分共价结合的性质。这种共价键的存在,使氟化钠的晶体结构稳定,在物理上?对化学性质也有影响。
。
。
氟化钠有共价键,因此它的物理性质与典型的离子化合物不同。例如,氟化钠的熔点和沸点比较低,这与离子结合成分少有关。氟化钠也受共价结合成分的影响,溶解度低,水分子不易破坏Na。和F吗?离子之间的共价结合。
。
。
氟化钠由于电负性的不同应该形成了离子键,但实际上晶体结构中存在共价结合成分。这种共价键是由Na形成的吗?和F吗?由于离子之间的电子云相互重叠,它们之间具有部分共价结合的性质。这种共价键的存在,使氟化钠的晶体结构稳定,在物理上?对化学性质也有影响。因此,氟化钠是共价键和离子键共存的化合物,为理解化学键的形成提供了新的视角。
。

3氟化钠的结合
氟化钠(aF)是一种常见的无机化合物,在工业和日常生活中被广泛使用。在探讨化学键的种类时,有必要从原子的电负性和电子结构,化学键的基本概念开始。
3
标签:化学结合。
3
电负性和化学键的关系。
在化学中,电负性是测量原子吸引电子能力的物理量。通常,当两个原子之间的电负性差大于1.7时,它们之间就会形成离子键。当电负性的差小于1.7时,有共价结合形成的倾向。
3
标签:电负性,化学键。
3
氟化钠的电负性分析。
氟化钠的电负性,钠(a)约0.93,氟(F)约3.98。这两个原子的电负性差是3.98 - 0.93 = 3.05,比1.7大得多。因此,根据电负性原则,氟化钠是由钠和氟之间的离子键形成的。
3
标签:氟化钠,电负性,离子键。
3
离子键和共价键的区别。
离子结合,通常是由于金属和非金属之间的正负离子的静电吸引力而形成的。另一方面,共价键是两个原子共有电子对,常见于非金属元素之间。在氟化钠中,钠原子失去一个电子变成a吗?氟原子得到一个电子变成F。两者通过静电引力连接在一起。
3
标签:离子键,共价键,静电引力。
3
氟化钠的结晶。
氟化钠的结晶结构为立方晶系,一个钠离子的周围围绕着六个氟化离子,另外一个氟化离子的周围围绕着六个钠离子。这种结构使得氟化钠的熔点和硬度都很高,是典型的离子结晶。
3
标签:晶体结构,离子晶体。
3
氟化钠的溶解性。
氟化钠具有强离子键,所以在水中的溶解性很好。氟化钠溶于水的时候,是a吗?和F吗?离子被水分子包围成为水离子,氟化钠溶于水。
3
标签:可溶性,水合离子。
3
总结一下
氟化钠是具有离子键的典型离子化合物。氟化钠的分子中存在钠原子和氟原子,但由于电负性大不相同,所以形成的不是共价键,而是离子键。
3
标签:离子键,共价键。
3氟化钠的结合
氟化钠(aF)是一种常见的无机化合物,在工业、医药、日常生活中都有使用。在讨论化学键的种类之前,先了解共价键和离子键。
3
标签:共享密钥。
3
共价键的定义和特征。
共价键是指两个原子共享一对或多对电子而形成的化学键。这种结合的特点是两个原子之间电子均匀分布,因此两个原子形成稳定的电子结构。共价键通常存在于氢(H2)、氧(O2)等非金属元素之间。
3
标签:离子键。
3
离子键的定义和特征。
离子键是指在静电引力的作用下形成的负离子之间的化学键。这种结合的特征是电子从一个原子转移到另一个原子,形成正离子和负离子。离子键通常存在于氯化钠(aCl)、氧化镁(MgO)等金属元素和非金属元素之间。
3
标签:氟化钠。
3
氟化钠的化学键类型。
氟化钠化学式为aF,由钠(a)和氟(F)组成。钠是金属元素,而氟是非金属元素。金属元素和非金属元素之间容易形成离子键,所以氟化钠中有可能含有离子键。
3
标签:电负性
3
电负性对判断化学键的类型很重要。
电负性是元素原子在化合物中吸引电子的能力的尺度。一般来说,当两个元件的电负性差大于1.7时,它们之间就容易形成离子键。当电负性差小于1.7时,它们之间容易形成共价键。钠的电负性为0.93,氟的电负性为3.98,两者之差为3.05,远远大于1.7。
3
标签:电子传输。
3
氟化钠中电子的转移。
氟化钠是钠原子失去一个电子,变成正的钠离子(a+),氟原子得到一个电子,变成负的氟离子(F?)变成了。这两个离子在静电引力的作用下相互吸引,形成稳定的离子键。氟化钠是具有离子键的离子化合物。
3
标签:总结。
3
来总结氟化钠的结合类型。
氟化钠的化学键是离子键。这种结合通过电子在钠原子和氟原子之间的移动,使两个原子形成稳定的电子结构。了解氟化钠化学键的种类有助于理解它的物理和化学性质。

3氟化钠是共有化合物吗?推进氟化钠的化学性质的分析。
在化学领域,化合物的分类一直是学者们关心的问题。在这些化合物中,共有化合物和离子化合物是两种最基本的化合物类型。本论文,探讨氟化钠的化学性质,分析是否是共价键化合物。
3
标签:化学性质,氟化钠,离子化合物,共价化合物。
3
一、氟化钠的组成和结构
氟化钠(aF)是一种无机化合物,由钠(a)和氟(F)组成。在氟化钠的结晶结构中,钠离子(a?)和氟离子(F?)是。通过静电引力相互吸引,形成稳定的离子结晶结构。
3
标签:氟化钠,组成,结构,离子结晶
3
二、离子化合物和共价化合物的区别
在化学中,离子化合物和共价化合物的主要区别在于结合方式。离子化合物是正负离子通过静电引力结合而成的,共价化合物是原子间共享电子对而形成的。
离子化合物的特征如下所示。具有较高的熔点和沸点,难溶于水,导电性低。共价化合物的特点如下:熔点和沸点低,易溶于水,导电性差。
3
标签:离子化合物,共价化合物,结合方式,特征。
3
三、氟化钠的结合方式。
从氟化钠的组成和结构来看,有可能是离子化合物。实际情况并没有那么简单。氟化钠介于离子化合物和共有化合物之间。
氟化钠中,钠离子和氟离子之间的静电引力很强,具有很高的熔点和沸点。因为氟的电负性大,钠原子失去电子后,正电荷和负电荷之间有共享性。因此,氟化钠的结合既不是完全的离子化合物,也不是共有化合物。
3
标签:结合方式,静电引力,电负性,共价共享性
3
四、氟化钠的溶解性和导电性。
氟化钠对水的溶解性低是因为水分子和氟化钠中的离子的相互作用弱。氟化钠的导电性很差,这是因为固体中的离子不能自由移动。
氟化钠溶于水后离子分离,显示出一定的导电性。据此,氟化钠可以在离子化合物和共价化合物之间结合。
3
标签:溶解性,导电性,离子,水。
3
五、结论。
氟化钠在离子化合物和共价化合物之间结合。它的熔点和沸点很高,但溶解性和导电性很低,表明它不是纯离子化合物或共有化合物。因此,可以认为氟化钠是一种特殊的化合物,其化学性质介于离子化合物和共价化合物之间。
3
标签:结论,结合方式,特殊化合物,离子化合物,共价化合物。
根据本论文的讨论,氟化钠的化学性质不是单一的类型,而是介于离子化合物和共价化合物之间。由于这种特殊的结合方式,氟化钠在化学领域具有独特的地位和应用价值。